باریم کلرید (BaCl2) چیست؟
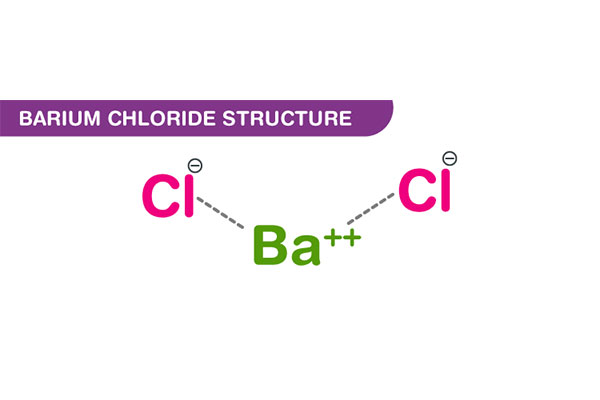
کلرید باریم شامل یک اتم باریم و دو اتم کلر میباشد و یک نمک غیر آلی است که از کاتیونهای باریم (Ba2+) و آنیونهای کلرید (Cl–) تشکیل شده است. این ماده جامد سفید رنگ است که در آب حل میشود، رطوبتخواهی دارد و به شعله رنگ زرد-سبزی کمی میدهد. فرمول شیمیایی آن BaCl2 است.
باریوم و کلر به دلیل واکنش پذیری ، به طور طبیعی ترکیباتی را تشکیل می دهند. رایج ترین شکل باریم در طبیعت ، نمک سولفات باریم ، BaSO4 است که به عنوان ماده معدنی باریت نیز شناخته می شود.
این ترکیب برای مصارف مختلف در صنایع شیمیایی و فلزات استفاده میشود، از جمله در تولید آلیاژهای باریم و در صنایع نساجی. همچنین، در تولید شیشه و تصفیه آب نیز مورد استفاده قرار میگیرد. این ترکیب به دلیل خواص فیزیکی و شیمیایی منحصر به فرد خود، در زمینههای مختلفی از جمله صنعت، آزمایشگاهی و پزشکی استفاده میشود.
مطالب مرتبط :
مشخصات کلرید باریم – BaCl2
| باریم کلرید | BaCl2 |
| وزن مولکولی کلرید باریم | 208.23 g/mol (anhydrous) |
| چگالی کلرید باریم | 3.856 g/cm3 (anhydrous) |
| دمای ذوب کلرید باریم | 962 °C |
| دمای جوش کلرید باریم | 1,560 °C |
کلرید باریم تا حد زیادی در آب حل میشود (همانند بیشتر نمکهای یونی). شناخته شده است که در حالت محلول، به یونهای باریم و یونهای کلرید تفکیک میشود. در دمای 20 درجه سانتیگراد، حلالیت کلرید باریم در آب تقریبا برابر با 358 گرم در لیتر است. با این حال، حلالیت این ترکیب در آب به دما بستگی دارد.
در دمای 100 درجه سانتیگراد، حلالیت آن در آب برابر با 594 گرم در لیتر است. این ترکیب همچنین در متانول حل میشود (با این حال، در اتانول حل نمیشود).
کاربردهای کلرید باریم (BaCl2)
- کلرید باریم به عنوان ماده اولیه برای تولید نمک باریم استفاده می شود.
- در صنایع کلر-قلیایی استفاده می شود.
- در تولید لاستیک استفاده می شود.
- در صنایع نفت و گاز به طور گسترده استفاده می شود.
- در صنعت ساخت کاغذ استفاده می شود.
- در تقویت فولاد استفاده می شود.
- برای تصفیه محلول نمکی استفاده می شود.
مطالب مرتبط :
تهیه کلرید باریم
صنعتی، این فرایند در دو مرحله انجام میشود.
مرحله 1: از سولفات باریم در دمای بالا
BaSO4 + 4C → BaS + 4CO
مرحله 2: از سولفید باریم
BaS + 2HCl → BaCl2 + H2S
میتوان از کلر نیز به جای اسید هیدروکلریک استفاده کرد.
همچنین میتوان آن را از کربنات باریم یا هیدروکسید باریم تهیه کرد.
مطالب مرتبط :
سوالات متداول:
عدد اکسایش باریم و کلر در BaCl2 چند است؟
مولکولهای کلرید باریم دارای اتصال یونی بین کاتیونهای باریم و آنیونهای کلرید میباشد. باریم یک فلز است که در این نمک یونی، وضعیت اکسایش +2 را نشان میدهد در حالی که کلر یک غیرفلز است که در BaCl2 وضعیت اکسایش -1 را نشان میدهد.
کلرید باریم برای چه استفاده می شود؟
کاربرد اصلی صنعتی BaCl2 در تصفیه محلولهای نمکی است که در کارخانجات کلر آهک استفاده میشوند. این ترکیب همچنین در سختکردن فولاد و تولید نمکهای درمان حرارتی استفاده میشود. این ترکیب به دلیل سمی بودن بالا محدودیتهای کاربردی دارد.
آیا کلرید باریم سمی است؟
بله، مانند اکثر نمکهای باریم، کلرید باریم (BaCl2) بسیار سمی برای انسانها است. تماس با این ترکیب میتواند تحریک چشم، غشاهای مخاطی و پوست را ایجاد کند. مصرف یا تنفس کلرید باریم نیز ممکن است مرگبار باشد. کلرید باریم همچنین میتواند بر سیستم عصبی مرکزی، سیستم قلبی عروقی و کلیهها تأثیر منفی بگذارد.
مطالب مرتبط :
کلرید باریم به صورت صنعتی چگونه تولید میشود؟
تولید صنعتی کلرید باریوم به دو مرحله انجام میشود. در ابتدا، سولفات باریوم (معمولاً به صورت ماده معدنی باریت) با کربن در دماهای بالا واکنش میدهد تا سولفید باریوم واکنش دهد و بخار کربن دیاکسید تشکیل شود. سپس، سولفید باریوم با اسید هیدروکلریک واکنش میدهد تا کلرید باریوم همراه با هیدروژن سولفید تولید شود.
ویژگیهای محلولهای آبی باریم کلرید چیست؟
محلولهای آبی ارزش pH خنثی دارند زیرا شامل کاتیون یک باز قوی و آنیون یک اسید قوی میباشند. هنگام تماس با سولفاتها، نشاط سفید باریم سولفات به دست میآید.
مطالب مرتبط :






یک پاسخ
کلرید باریم همان باریت است؟